Der Einfluss des Drucks auf die Lage des chemischen Gleichgewichts
(Reaktion von Distickstofftetraoxid zu Stickstoffdioxid)
Wir betrachteten einen Film im Internet, in dem gezeigt wurde, wie das Stoffgemisch auf Druckänderungen reagiert.
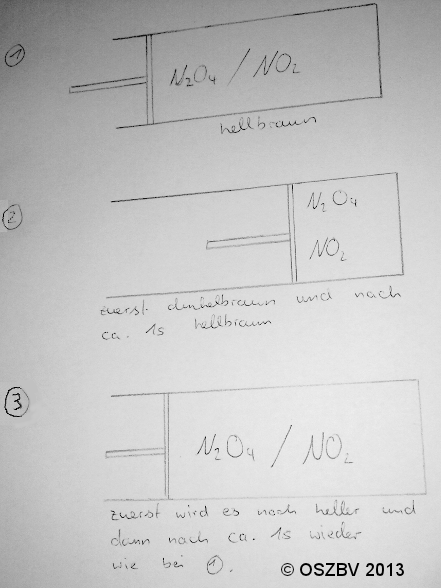
Versuchsskizze:
Die Skizze enthält auch die Versuchsbeobachtungen.
Versuchserklärung:
Reaktionsgleichung:
N204 ⇌ 2N02
Volumen Edukte ↔ Volumen Produkte
Volumen Edukte ↔ Volumen Produkte
Bei 1) liegt das chemische Gleichgewicht auf der Seite des Produkts bei Stickstoffdioxid, was die Farbe anzeigt.
Bei 2) wird das Gasgemisch dunkler, da die Konzentration steigt. Gleichzeitig steigt der Druck. Das chemische Gleichgewicht ändert nach ca. 1 Sekunde seine Lage nach links und befindet sich bei Distickstofftetraoxid.
Bei 3) wird das Gas durch die Konzentrationsabnahme während der Ausdehnung heller. Gleichzeitig sinkt der Druck. Die anschließende Farbänderung zu braun zeigt an, dass sich die Lage des chemischen Gleichgewichts wieder nach rechts in Richtung von Stickstoffdioxid verschoben hat.
Bei einer Druckerhöhung verschiebt sich die Lage des chemischen Gleichgewichts in der Richtung, in der das System weniger Volumen einnimmt, also zu Distickstofftetraoxid. Denn je mehr Distickstofftetraoxid vohanden ist, desto kleiner ist das Volumen des Gasgemisches. Bei einer Druckabsenkung verschiebt sich die Lage des chemischen Gleichgewichts in der Richtung, in der das System mehr Volumen einnimmt, also zu Stickstoffdioxid. Denn je mehr Stickstoffdioxid vorhanden ist, desto größer ist das Volumen des Systems.
Erstellt von Pero G. mit Ergänzungen durch Herrn Ecker. 17.3.2013