
Katalyse am Beispiel der Reaktion von Wasserstoff und Sauerstoff
Versuch 1: mit Platinkatalysator
Geräte/Chemikalien:
Tiegelzange, Platinkatalysator, Wasserstoff, Glasdüse mit Stahlwolle
Versuchsdurchführung:
Wasserstoff wird durch die Glasdüse auf den Platinkatalysator gerichtet.
VB:
Der Platinkatalysator glüht auf und der Wasserstoff entzündet sich.
Die Flamme ist orange gefärbt.
Versuchserklärung
Der Wasserstoff reagiert mit dem Sauerstoff in einer exothermen Reaktion:
Wasserstoff und Sauerstoff reagieren aber erst miteinander, wenn die
nötige Aktivierungsenergie zugeführt wird.
Der Einsatz des Platin-Katalysators senkt die Aktivierungsenergie,
so dass die Reaktion schon bei Raumtemperatur ablaufen kann.
Vorgänge an der Oberfläche:
Die Wasserstoffmoleküle landen auf der Platinoberfläche. Die Bindung der
Wasserstoffatome wird schwächer und sie verbinden sich mit den frei
beweglichen Elektronen des Platinmetalls. Dadurch wird die innermolekulare
Bindung zwischen den Wasserstoffatomen aufgebrochen.
Weil die Elektronen frei beweglich sind, können die Wasserstoffatome auf der
Oberfläche des Platins wandern.
Sauerstoffmoleküle aus der Luft landen ebenfalls auf der Oberfläche des
Platins und reagieren mit den Wasserstoffatomen. Dabei löst sich die Bindung
zwischen den Wasserstoffatomen und Platin, so dass die Wasserstoffatome das
Sauerstoffmolekül angreifen können. Zuerst bricht eine innermolekulare
Bindung auf, wobei zwei Wasserstoffatome angelagert werden. Anschließend
wird die zweite Bindung angegriffen. Wenn insgesamt vier Wasserstoffatome
mit dem Sauerstoffmolekül reagiert haben sind zwei Wassermoleküle entstanden.
Wegen der bei der exothermen Reaktion entstandenen Wärme besitzen die
Wassermoleküle eine große kinetische Energie. Sie verlassen deshalb die
Oberfläche des Platins.
Reaktion von Wasserstoff und Sauerstoff auf einem Pt-Katalysator.
Geräte/Chemikalien:
Luftballon, Kerze, Wasserstoff, Sauerstoff
Versuchsdurchführung:
Der Luftballon wird mit einem Wasser-Sauerstoffgemisch befüllt und losgelassen. Dann wird die Kerze an den Ballon gehalten.
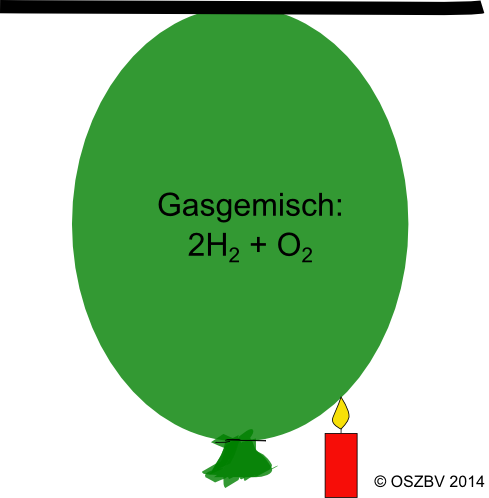
VB:
Der Ballon steigt nach oben an die Decke (siehe Video oder Skizze). Es findet keine chemische Reaktion statt. Erst wenn die Kerze an den Ballon gehalten wird findet eine explosive Verbrennung statt.
Gekürztes Versuchsvideo von Lisa Hentzschler
VE:
Wasserstoff verbrennt mit dem Sauerstoff zu Wasserdampf. Im Ballon sind die Reaktionspartner komplett durchmischt, dass heißt jedes Wasserstoffmolekül ist von Sauerstoffmolekülen umgeben und kann deshalb sofort mit Sauerstoff reagieren. Die Reaktion verläuft exotherm.
Auswertung der beiden Versuche:
Der Text fehlt hier noch komplett!!!
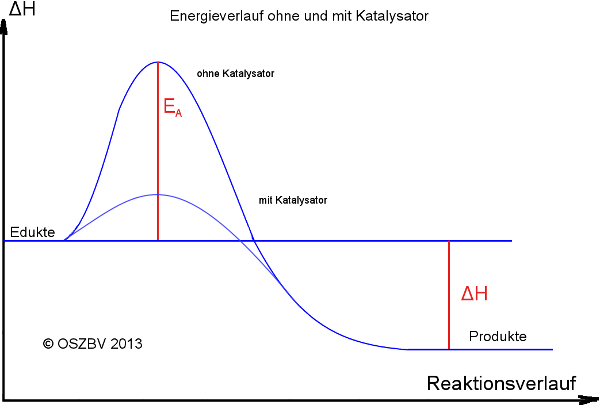
Reaktionsverlauf der exothermen Reaktion mit und ohne Katalysator.
Erstellt von I.A. 5.3.2014