
Polykondensation von Zitronensäure
Geräte/ Chemikalien:
Schutzbrille, Reagenzglashalter, Reagenzglasständer, Spatel, Reagenzglas, Bunsenbrenner, Glimmspahn/Holzstäbchen, Gasanzünder
Versuchsaufbau:
Versuchsdurchführung:
1. Mit dem Spatel werden etwa 2 cm Zitronensäure in das Reagenzglas geben.
2. Das Reagenzglas wird mit dem Reagenzglashalter über die Flamme halten.
3. Das Reagenzglas wird in der Flamme hin- und herbewegt.
4. Bei einer Orangefärbung der Schmelze wird das Erhitzen beendet.
5. Dann lässt man die Schmelze abkühlen.
6. Das Holzstäbchen in die zähflüssige Schmelze tauchen und langsam herausziehen.
Versuchsbeobachtung:
1. Beim Erhitzen der Zitronensäure, wird der weiße kristalliner Feststoff langsam flüssig und schäumt auf. Dabei entweicht weißer Dampf.
2. Die Schmelze riecht schwach nach verbranntem Plastik.
3. Die Schmelze bekommt zuerst eine gelbe Farbe und schließlich eine orangene Farbe.
4. Die Schmelze wird beim Abkühlen zähflüssig und es lässt sich ein Faden herausziehen.

Versuchserklärung:
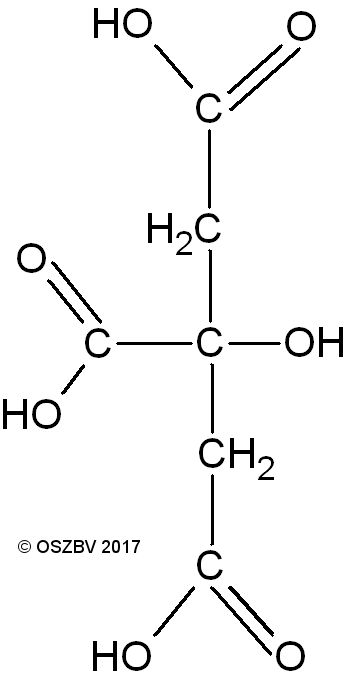
Das Zitronensäuremolekül besitzt drei Carboxylgruppen und eine Hydroxylgruppe und alle Gruppen sind polar aufgebaut. In der Schmelze können sich die Moleküle bewegen und treffen dabei aufeinander. Wegen der polaren Gruppen ziehen sie sich untereinander an und reagieren miteinander:
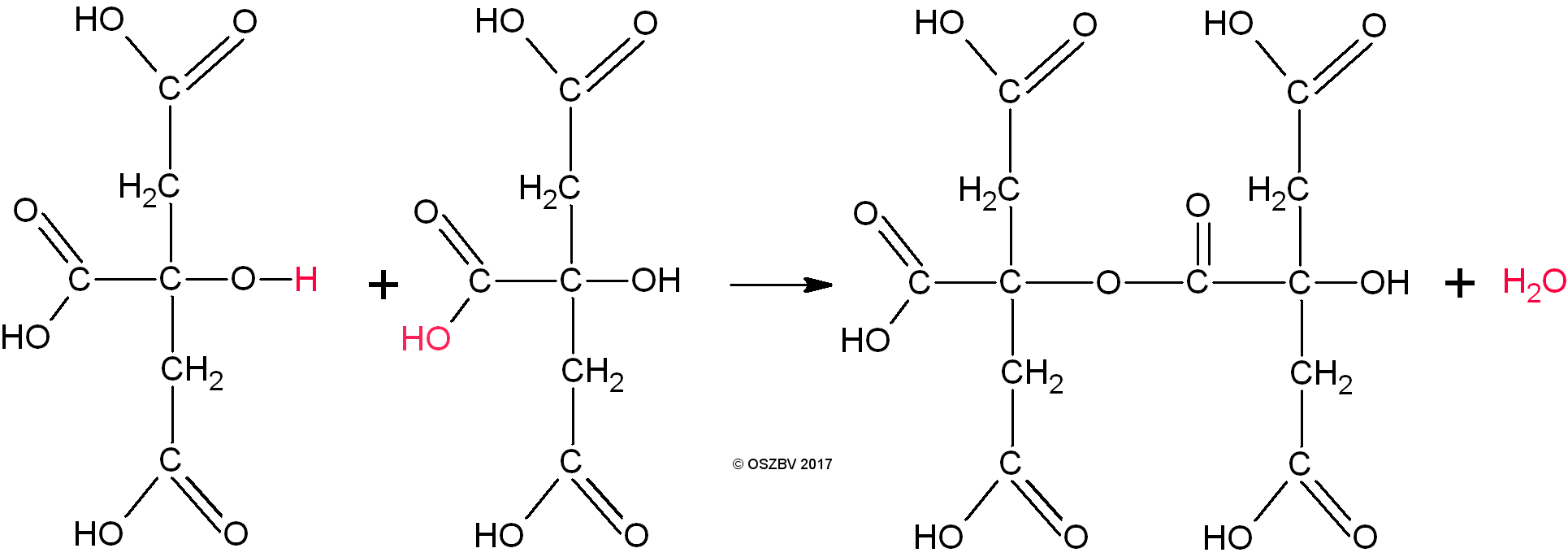
Reagieren eine Carboxylgruppe und eine Hydroxylgruppe miteineander so wird das Veresterung genannt.
Dabei wird ein Wassermolekül abgespalten. Deshalb wird solch eine Reaktion auch Kondensation genannt.
Weil das bei der Reaktion entstehende Dimer noch immer beide funktionellen Gruppen bestitzt, kann die Reaktion weitergehen. Als nächstes entsteht ein Trimer und dann nach und nach ein Polymer. Die einzelnen Zitronensäuremoleküle sind also die Bausteine des Polymers. Die werden deshalb Monomere genannt.
Hier fehlt noch ein Bild des Trimers und des Polymers!
Erstellt von Fatima Hashemi mit kleinen Ergänzungen durch Herrn Ecker 24.1.23