
Untersuchung des Essigsäuregleichgewichts mit Hilfe der Leitfähigkeit
Einleitung:
Geräte/Chemikalien:
Leitfähigkeitsmessgerät, Becherglas 250ml, 0,1 molare Essigsäure, 1,0 molare Essigsäure, Pipette, demineralisiertes Wasser
Versuchsaufbau:

Versuchsaufbau: Leitfähigkeitsmessung von Essigsäure in Abh. von der Konzentration
Versuchsdurchführung:
100ml demineralisiertes Wasser werden in ein Becherglas gegeben und die Leitfähigkeit gemessen. Dann werden 8x 1,0 ml 0,1 molare Essigsäure dazugegeben und jeweils die Leitfähigkeit gemessen. Anschließend werden 10x 1,0 ml 1 molare Essigsäure dazugegeben und jeweils die Leitfähigkeit gemessen.
Versuchsbeobachtungen:
Die Leitfähigkeit steigt mit wachsender Konzentration der Essigsäure immer geringer.
Messwerttabelle:
| c in mol/l | σ in mS/cm |
|---|---|
| 0,00000 | 0,004 |
| 0,00099 | 0,015 |
| 0,00196 | 0,026 |
| 0,00291 | 0,035 |
| 0,00385 | 0,041 |
| 0,00476 | 0,045 |
| 0,00566 | 0,050 |
| 0,00654 | 0,053 |
| 0,00741 | 0,057 |
| 0,01651 | 0,083 |
| 0,02545 | 0,100 |
| 0.03423 | 0,115 |
| 0.04286 | 0,129 |
| 0.05133 | 0,141 |
| 0.05965 | 0,151 |
| 0.06783 | 0,161 |
| 0.07586 | 0,170 |
| 0.08376 | 0,180 |
| 0.09153 | 0,188 |
| 0.09916 | 0,198 |
Versuchserklärung:
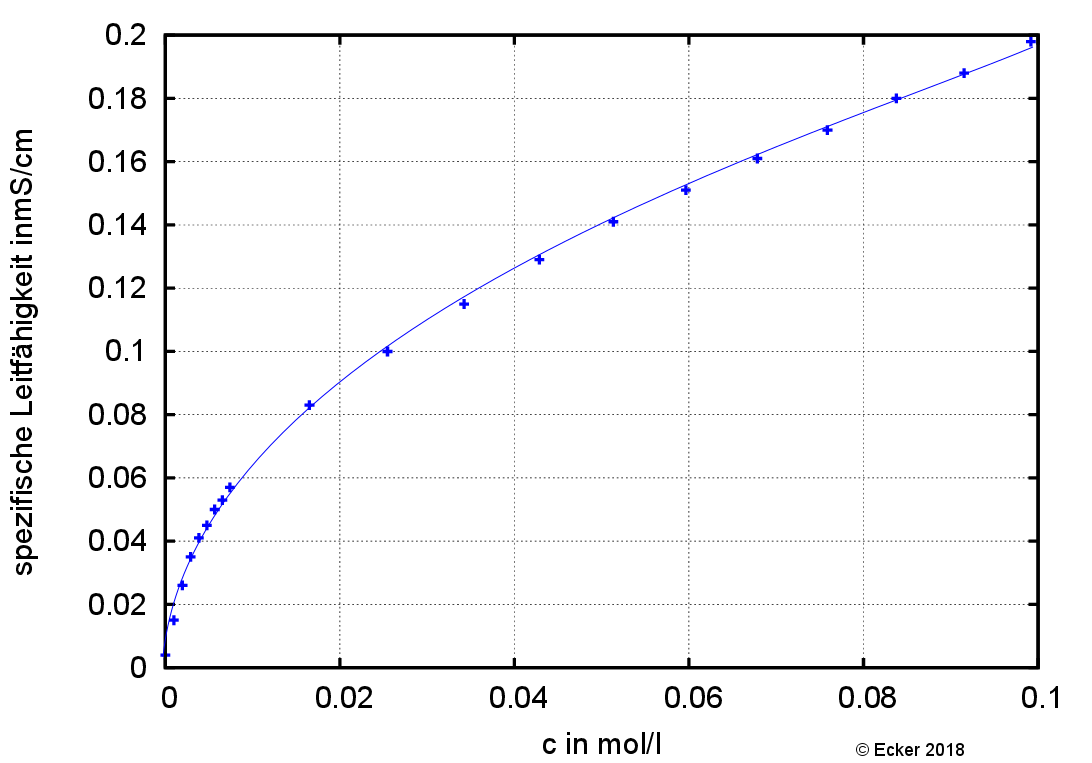
Leitfähigkeit von Essigsäure in Abh. von der Konzentration
Man erwartet bei der Zugabe von Essigsäure einen Anstieg der Leitfähigkeit. Denn durch die Reaktion mit Wasser entstehen Ionen, die zu einer besseren Leitfähigkeit führen.
Durch die Zugabe von Essigsäure zum System wird der Anteil des Wassers immer geringer. Es wirkt also so, als ob dem System im Gleichgewicht Wasser (Edukt) entzogen wird. Nach dem Prinzip von LeChatelier verschiebt sich das Gleichgewicht deshalb zu den Edukten und dadurch sind immer mehr der zugegebenen Essigsäuremoleküle nicht dissoziiert. Aus diesem Grund steigt die Leitfähigkeit weniger, als man erwarten würde.