
Das chemische Gleichgewicht
Viele chemische Reaktionen sind umkehrbar, sie können also sowohl in die eine als in die andere Richtung ablaufen. Die Hin- und die Rückreaktion verlaufen dabei gleichzeitig. Während also Edukte zu Produkten reagieren, werden umgekehrt auch Produkte wieder in die Edukte umgewandelt.
Beispiel:
Bei der Verbrennung von Wasserstoff bildet sich Wasser in einer exothermen Reaktion.
Es kann aber auch die umgekehrte Reaktion ablaufen. In einer endothermen Reaktion entsteht dann aus Wasser ein Gemisch aus Wasserstoff und Sauerstoff.
ΔH<0 Hinreaktion
und
ΔH>0 Rückreaktion
Je nach Konzentration der Stoffe, verlaufen die Hin– und die Rückreaktionen unterschiedlich schnell.
Reagieren pro Zeiteinheit genauso viele Edukte zu Produkten wie Produkte zu Edukten, spricht man vom Gleichgewichtszustand.und
ΔH>0 Rückreaktion
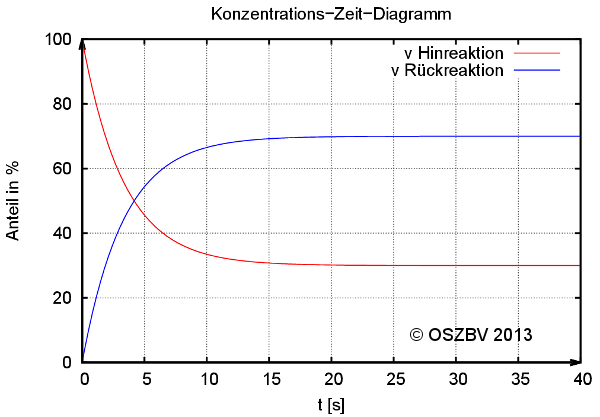
Zeitlicher Verlauf der Gleichgewichtseinstellung einer chemischen Reaktion.
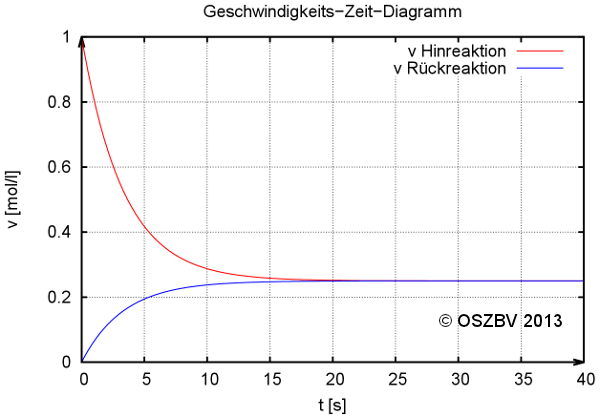
Geschwindigkeits-Zeit-Diagramm einer chemischen Reaktion.
Für die Beträge der Geschwindigkeiten beim Erreichen des chemischen Gleichgewichts gilt:
ΔH<0
Bei einer Temperatur von 2000K liegt das chemische Gleichgewicht dieser Reaktion fast ganz auf der Seite der Edukte (96%), aber es sind
auch 4% der Edukte vorhanden.Für Chemiker ist es nun besonders wichtig wie die Lage des chemischen Gleichgewichts von Gleichgewichtsreaktionen beeinflusst werden kann. Das wird in den nächsten Unterrichtseinheiten untersucht. Erstellt von Neslihan Ö. mit Ergänzungen von Herrn Ecker.
Gedankenexperiment zum chemischen Gleichgewicht
Einleitung:
Dieses Gedankenexperiment dient zum besseren Verständnis des dynamischen Charakters des chemischen Gleichgewichts.
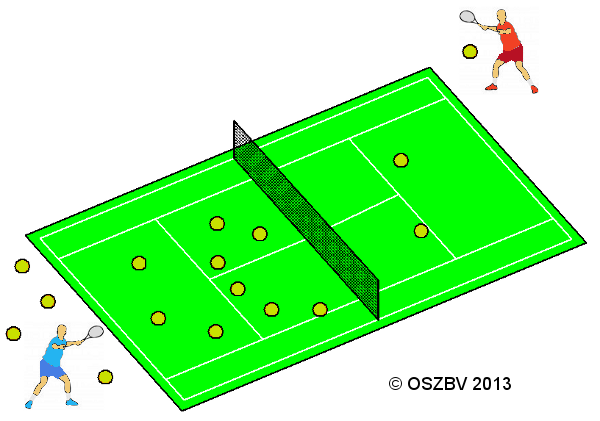
Gedankenexperiment zum chemischen Gleichgewicht.
Zwei Spieler wollen Tennis spielen. Der rechte Spieler hat ein riesigen Haufen Tennisbälle mitgebracht, der andere Spieler hat keine mitgebracht.
Der rechte Spieler hat eine deutlich höhere Schlagzahl (Hinreaktion) als der linke Spieler (Rückreaktion). Solange noch Bälle auf dem Haufen sind hat der rechte Spieler seine volle Schlagzahl. Gleichzeitig schießt der Gegner von der linken Seite einige wenige Bälle zurück (Hin- und Rückreaktion laufen gleichzeitig ab).
Irgendwann sind die Bälle so verteilt, dass sich auf der linken Seite viel mehr Bälle (Produkte) befinden, als auf der rechten Seite (Edukte). Allerdings ist dann auch der Haufen abgearbeitet. Dann muss der rechte Spieler weite Wege gehen um die Bälle zu finden und zu schlagen, dadurch sinkt seine Schlagzahl (Verlangsamung der Hinreaktion). Gleichzeitig hat der Spieler auf der linken Seite kürzere Wege um die Bälle zu finden und zu schlagen (Beschleunigung der Rückreaktion), als der Spieler auf der rechten Seite.
Nach einiger Zeit pendelt sich die Schlagzahl beider Spieler auf die gleiche Anzahl ein (Hin- und Rückreaktion sind dann gleich schnell). Ab diesem Zeitpunkt ändern sich auf der linken und rechten Seite die Anzahl der Bälle nicht mehr (chemisches Gleichgewicht ist erreicht und liegt auf der Seite der Produkte). Erstellt von Hussein R. mit Ergänzungen von Herrn Ecker.