
Das Benzolmolekül im Orbitalmodell
Einleitung:
Polystyrol ist ein Polimerisat, das aus Styrol durch Polymerisation entsteht. Das Monomer besitzt einen Benzolring. Die Struktur diess Ringes soll hier erläutert werden.
Historische Entwicklung der Benzolformel:
Lange hatte man überlegt wie das Benzolmolekül aufgebaut ist und wie die
Struktur dieses Moleküls aussieht.
Michael Faraday hatte durch eine quantitative Elementaranalyse angenommen,
dass das Benzol gleich viele Kohlenstoffatome besitzt wie Wasserstoffatome.
Die Summenformel des Benzol wurde von Mitscherlich aufgestellt und lautet:
C6H6
Man wusste anfangs nicht genau ob das Benzolmolekül zu den gesättigten oder
ungesättigten Kohlenwasserstoffen gehört, denn das Benzolmolekül verhält sich
einerseits ähnlich wie ein ungesättigter und andererseits wie ein gesättigter
Kohlenwasserstoff.
August Kekulé entwickelte die Strukturformel des Benzols mit drei konjugierten
Kohlenstoff-Kohlenstoff-Doppelbindungen (-C=C-) in einem Ring.
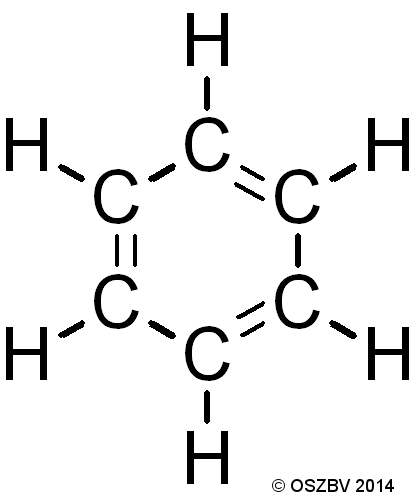
Strukturformel des Benzolmoleküls von A.N.
Durch die unterschiedlichen Bindungsverhältnisse zwischen den Kohlenstoffatomen müsste die Form des Benzols ein unregelmäßiges Sechseck bilden. Da Einfachbindungen länger als Doppelbindungen sind.
Mithilfe von modernen Untersuchungsmethoden konnte man aber feststellen, dass die Bindungslängen zwischen den Kohlenstoffatomen alle gleich lang sind. Die Winkel zwischen den Kohlenstoffatomen sind auch alle gleich und betragen 120°. Außerdem liegen alle Atome auf einer Ebene und sind somit planar angeordnet.
Kekulé's Strukturmodell war demnach ungenau und bildete Bindungsverhältnisse des Benzolmoleküls nur z.T. richtig ab.
Orbitalmodell und Mesomerie:
Um ein besseres Modell des Benzols zu erhalten, in dem alle Bindungen gleich
lang sind, muss man das Orbitalmodell von Benzol betrachten.
Die Kohlenstoffatome des Benzols sind alle sp²-hybridisiert. Diese
Hybridorbitale bilden mit den benachbarten Bindungspartnern ein σ-Bindungen
aus, die das Grundgerüst des Moleküls bilden.
Neben den sp²-Hybridorbitalen gibt es noch sechs pz-Atomorbitale die nicht
an der Hybridisierung beteiligt sind. Die sechs pz-Orbitale stehen senkrecht
zum Grundgerüst der σ -Bindungen. Dabei überlappen die pz-Orbitale und bilden
π-Bindungen aus, die eine ringartige Struktur ober- und unterhalb der Molekülebene bilden.
Innerhalb der von den pz-Orbitalen gebildeten Ringe können sich die
π-Elektronen frei bewegen. Sie sind delokalisiert (nicht mehr einzelnen Atomen
zugeordnet) und verteilen sich gleichmäßig im Molekül.
pz-Orbitale des Benzolrings von A.N.
Überlagerte pz-Orbitale des Benzolrings
Für diese Eigenschaft des Benzols, hatte man eine neue Strukturformel entwickelt, die den Zustand der Elektronen des Benzols besser und eindeutig beschreibt. Anstelle der Doppelbindungen wird ein Kreis gezeichnet, der die delokalisierten Elektronen darstellt:
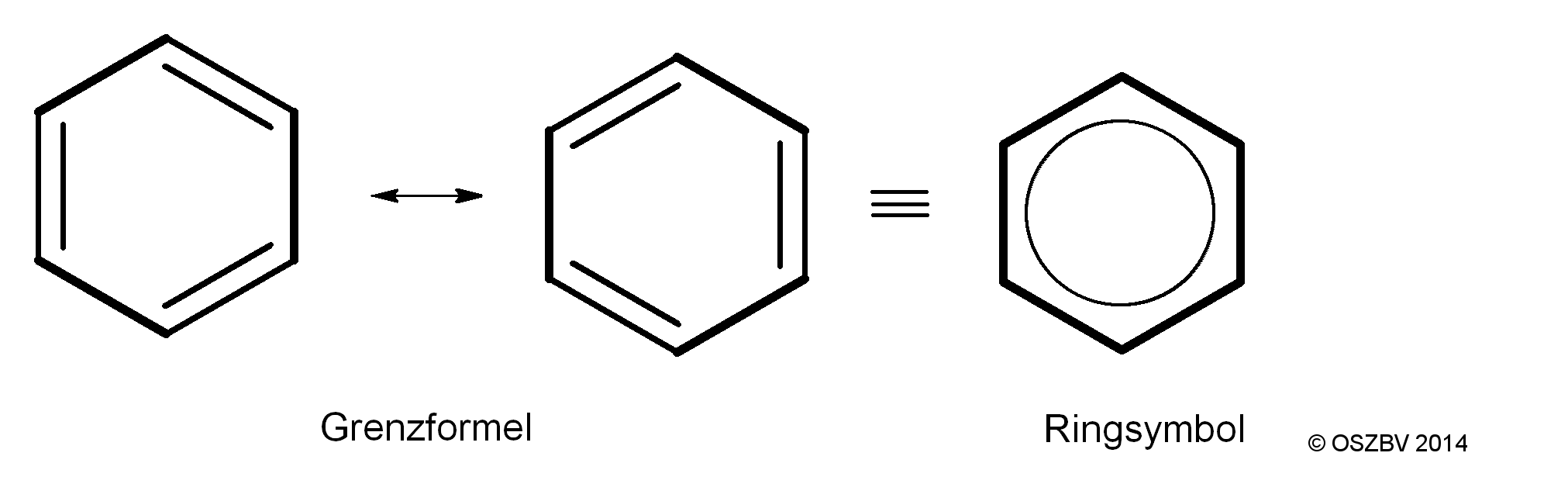
Grenzstrukturen des Benzolmoleküls von A.N.
Kekulé hatte nicht ganz unrecht mit seiner Überlegung, denn die Elektronen können so vorliegen. Die Strukturformel von Kekulé nennt man Grenzformel, da sie nur ein Teil der Information des Moleküls darbieten.
Es gibt noch eine zweite Grenzformel, die aber energetisch identisch ist. In der Realität ist die Anordnung der Elektronen im Benzolmolekül aber mehr zwischen diesen beiden Grenzformeln. Deshalb bezeichnet man das Benzolmolekül auch als mesomeres (zwischen) System.
Interessanterweise stabilisieren die delokalisierten π-Elektronen das Elektronensystem, so dass das Benzolmolekül energetisch niedriger ist, als ein hypothetisches Cyclohexatrienmolekül.
Der Betrag dieser Energieabsenkung wird als Mesomerieenergie des Benzols bezeichnet.
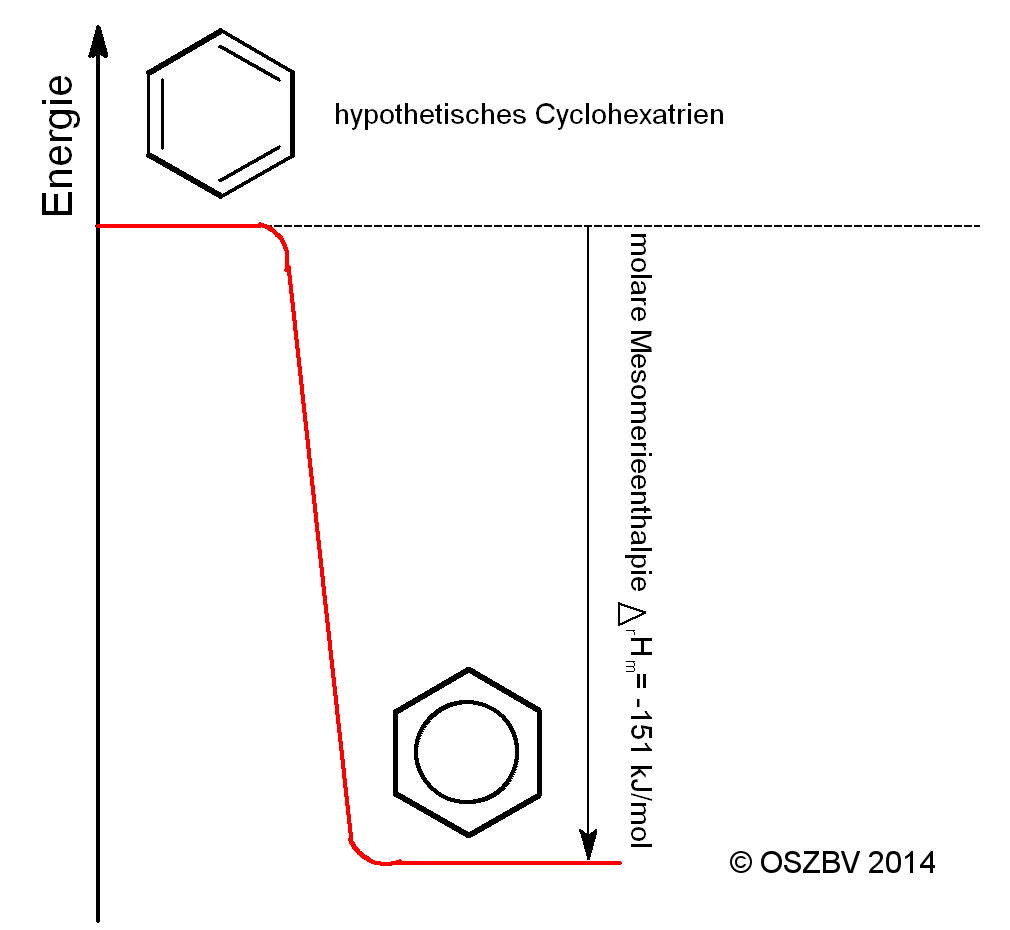
Mesomerieenergie des Benzolmoleküls von A.N.
Erstellt von A. N. mit kleinen Ergänzungen durch Herrn Ecker 24.11.2014