
Nachweisreaktionen von Proteinen
Bisher erhaltene Fotos (verkleinert) - ohne jede Angabe (praktisch wertlos)!


Geräte/Chemikalien:
Reagenzgläser, Reagenzglashalter, Vollpipette, Pipette, Wasserbad, Bunsenbrenner, Reagenzglasständer, Spatel, Bechergläser, Stoppuhr, Filterpapier, Natriumchlorid, Natronlauge (c=1 mol/l) , Eiklar, destilliertes Wasser, Salzsäure (c=1 mol/l), Salpetersäure (konz.), Glycin -, Tyrosin - und Serinlösung, Kupfersulfatlösung (verd.), Ninhydrin - Sprühreagenz
Denaturierung
Durchführung:
Das Eiklar wird mit destilliertem Wasser und Natriumchlorid verdünnt (Eiklarlösung). Die Eiklarlösung wird in 3 Reagenzgläsern, pro Reagenzglas je 5 ml, aufgefüllt. In das erste RG wird 5 ml Salzsäure dazugegeben. In das zweite RG wird 5 ml Natronlauge hinzugegeben. Das dritte RG wird über einem Bunsenbrenner erhitzt.
Beobachtung:

Durch das Natriumchlorid wurde die Eiklarlösung klarer. Im RG mit der Salzsäure, bildete nach dem Schütteln ein weißer Niederschlag, der sehr langsam bis gar nicht auf dem Boden absetzt. Im RG mit der Natronlauge ist keine Veränderung sichtbar. Beim dritten Reagenzglas wurde die Eiklarlösung fest (geronnen).
Auswertung:
Eiklar besteht zu ca. 10% aus einem Protein namens Eiweiß.
Wenn man Salzsäure in die Eiklarlösung hinzugibt, werden die Tertiärstruktur und Sekundärstruktur des Eiweißes zerstört.
Dabei lagern sich die Protonen z.B. an die Ionenbindungen, die die Sekundärstruktur und die Tertiärstruktur stabilisieren, an und bewirken Abstoßungskräfte. Diese führen dazu, dass die jeweiligen Strukturen zerstört werden.
Das Protein besitzt dann nur noch die Primärstruktur, so dass die Seitenketten ungebunden vorliegen.
Da es einige Aminosäuren mit unpolaren Seitenketten in dem Protein gibt, können diese nicht in Wasser gelöst werden.
Ein weißer Niederschlag bleibt übrig.
Warum man bei dem Versuch mit Natronlauge nichts erkennen kann, liegt wohl an der Konzentration der Natronlauge. Die Konzentration war zu niedrig um die Tertiärstruktur zu zerstören. Bei höherer Konzentration hätten die Hydroxidionen ebenfalls die Ionenbindungen zerstören können.
Beim Erhitzen der Eiklarlösung werden die schwachen Bindungen (Wasserstoffbrückenbindung und Van-der-Waals-Kräfte) zwischen den Seitenketten getrennt. So können die Seitenketten der jeweilige Aminosäuren Bindungen mit anderen Seitenketten von anderen Aminosäuren eingehen.Dadurch werden die Sekundär- und die Tertiärstruktur des Proteins zerstört und die physikalische Eigenschaft des Eiklars ändert sich.
Biuret-Reaktion
Durchführung:
Befüllung der Reagenzgläser:1. 4 ml Tyrosinlösung + 1 ml Natronlauge
2. 4 ml Serinlösung + 1 ml Natronlauge
3. 4 ml Eiklarlösung + 1 ml Natronlauge
Anschließend werden zu jedem RG einige Tropfen Kupfersulfatlösung hinzugegeben.
Beobachtung:

Auswertung:
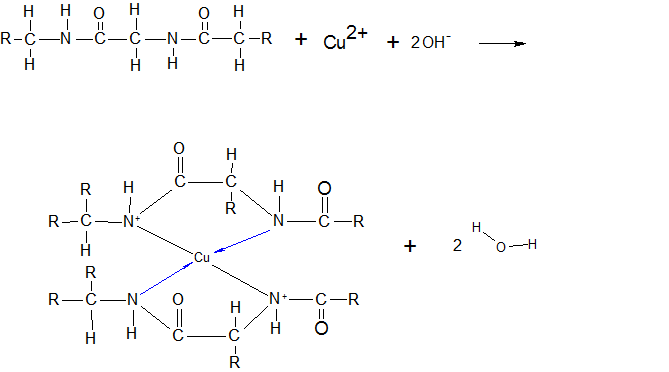
Mithilfe der Biuretreaktion kann man Peptidbindungen bzw. Eiweiß nachweisen.
Durch die Natronlauge wird die Tertiär- und Sekundärstruktur zerstört,
sodass die Kupfer-Ionen an die Peptidbindungen heran kommen können.
Die Kupfer-Ionen bilden mit der Eiklarlösung eine blau-violette
Komplexverbindung.
Mit den Aminosäuren und den Kupfer-Ionen bilden sie eine dunkelblaue Färbung.
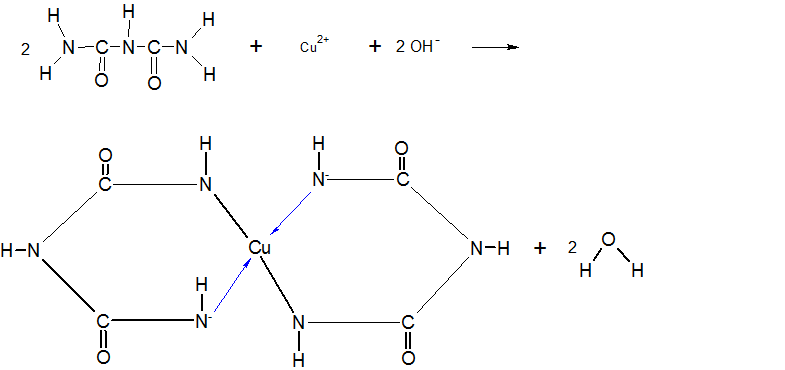
Der Name Biuret-Reaktion entstand durch die Kondensation von zwei Harnstoffmolekülen unter Abspaltung von Ammoniak. Das Produkt, das entsteht heißt Biuret. Das Biuret bildet mit den Kupfer-Ionen auch eine Komplexverbindung, die eine blau-violette Färbung aufweist.
Xanthoprotein-Reaktion
Durchführung:
Durchführung:
Die folgenden Gemische werden im Wasserbad erhitzt:
1. 2 ml Tyrosinlösung und 4 ml Salpetersäure
2. 2 ml Serinlösung und 4 ml Salpetersäure
3. 2 ml Eiklarlösung und 4 ml Salpetersäure
Beobachtung:
Bei dem Reagenzglas mit Serinlösung konnte man keine Veränderungen erkennen. Bei dem Reagenzglas mit Tyrosinlösung und Eiklarlösung färbte sich die Lösungen gelb.
Auswertung:
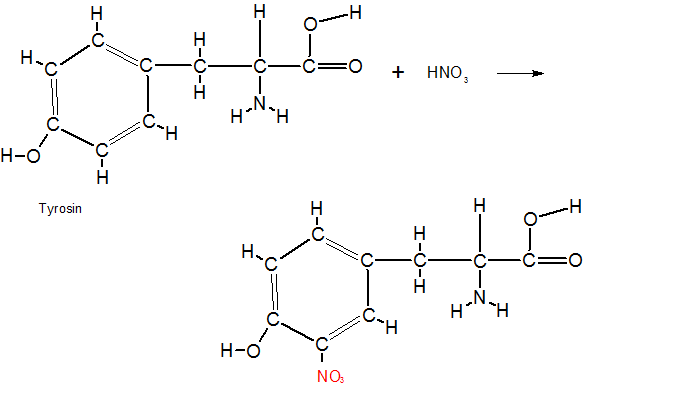
Bei der Xanthoprotein-Reaktion (xanthos: griechisch Gelb)
werden aromatische Ringe durch die Salpetersäure nitriert.
Da im Eiweiß Aminosäuren mit aromatische Seitenketten vorhanden sind, reagiert es positiv auf den Nachweis.
Das Tyrosin besitzt eine aromatische Seitenkette.
Serin besitzt keine aromatische Ringe, weshalb die Reaktion negativ verlief.
Erstellt von A.N.