
Katalyse nennt man den Vorgang bei dem chemische Reaktionen schneller und energieeffizienter ablaufen.
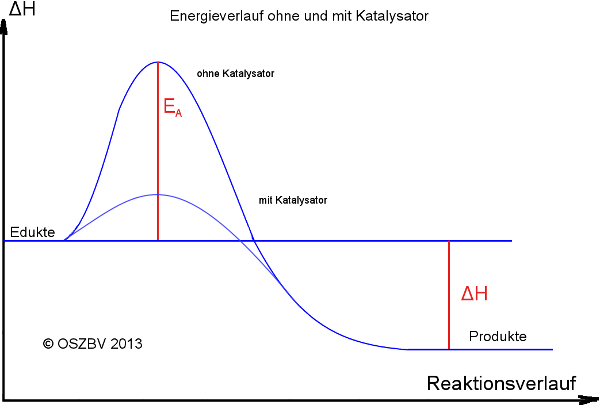
Katalysatoren sinken die Aktivierungsenergie. Dadurch erhöhen sie die Reaktionsgeschwindigkeit. Und eröffnen alternative energieärmere Reaktionsschritte.
1. Versuch: Wasserstoff reagiert mit Sauerstoff in einem Ballon
VD: An einen Ballon gefüllt mit Wasserstoff und Sauerstoff wird nach einiger Zeit eine Kerze gehalten.
VB: Das Gemisch entzündet sich nicht von selbst. Erst bei Erwärmung mit der Kerze entzündet es sich explosionsartig.
VE: Diese Reaktion verläuft exotherm. Zum Start der Reaktion ist Aktivierungsenergie notwendig.
2. Versuch: Wasserstoff reagiert mit Luftsauerstoff
VD: Ein Wasserstoffstrahl kommt durch eine Düse und wird mit einer Feuerzeugflamme entzündet.
VB: Der Wasserstoffstrahl, zündet nicht von selbst, sondern wird erst an der Kerzenflamme entzündet.
VE: Diese Reaktion verläuft exotherm. Zum Start der Reaktion ist Aktivierungsenergie notwendig.
3. Versuch: Wasserstoff reagiert mit Luftsauerstoff an einem Platinkatalysator
VD: Der Wasserstoffstrahl wird an der Platinwolle gehalten.
VB: Die Platinwolle glüht an dem Ort, auf der Wasserstoffstrahl auftritt und anschließend entzündet sich der Wasserstoffstrahl an dieser Glut.
VE: Der Katalysator senkt die Aktivierungsenergie ab, wodurch die Reaktionsgeschwindigkeit erhöht wird und seine Anwesenheit ermöglicht einen anderen Reaktionsweg.
A + B → AB (ohne Kat)
A + K → AK
AK + B → AB + K (mit Kat)
A + K → AK
AK + B → AB + K (mit Kat)
Versuchsaufbau
Mikroskopisch betrachtet treffen die Wasserstoffmoleküle auf die Platinoberfläche und werden dort zerlegt. Die Wasserstoffatome können an der Platinoberfläche wandern und zu den aus der Luft abgelagerten Sauerstoffmolekülen gelangen. Die Wasserstoffatome verbinden sich dann mit den Sauerstoffmolekülen, die dabei zerlegt werden, wobei Wassermoleküle entstehen. Die Wassermoleküle besitzen wegen der exothermen Reaktion sehr viel Energie, weshalb sie die Platinoberfläche verlassen.
Erstellt von Fatima Hashemi mit Ergänzungen durch Herrn Ecker 12.2.24
Serviceteil